زراعة الأعضاء: ماهيتها وماهي مراحلها وما يخبئه المستقبل
زرع الأعضاء هو الإجراء الجراحي الذي يتم بموجبه استبدال عضو أو أكثر من الأعضاء المريضة (التي لم تعد وظيفتها قابلة للاسترداد) بعضو واحد أو أكثر مأخوذ من متبرع (جثة أو حية)
عملية لها جذورها ، من الناحية المفاهيمية ، في أقدم تاريخ للبشرية (تم التحدث عنها لأول مرة من قبل الأطباء الصينيين) ، ومع ذلك فهي حل علاجي حديث جدًا: المعرفة التي جعلت ذلك ممكنًا (علم المناعة ، دراسة المستضدات ...) تم الحصول عليها فقط في بداية القرن العشرين.
منذ عام 1950 فصاعدًا ، أصبح الزرع خيارًا راسخًا في علاج تلك الأمراض التي تؤدي إلى تدمير العضو بشكل لا يمكن إصلاحه ، وبالتالي إلى وفاة المريض.
لكن الزرع ليس فقط الاحتمال الأخير لأولئك الذين تكون حياتهم في خطر: فهذه العملية تجعل من الممكن أيضًا تحسين نوعية الحياة لأولئك المرضى الذين يعانون من أمراض معيقة مزمنة (مثل زرع الكلى لمرضى غسيل الكلى).
لا يزال مستقبل الزرع قيد التخطيط ، ولكنه واضح جدًا في أذهان العلماء والأطباء المشاركين في الأبحاث: زراعة أعضاء أو أعضاء اصطناعية مأخوذة من حيوانات معدلة وراثيًا (xenotransplantation) ، والاستنساخ وزرع الخلايا الجذعية ليست سوى بعض من الاتجاهات التي يتحرك فيها المشهد العلمي في العالم.
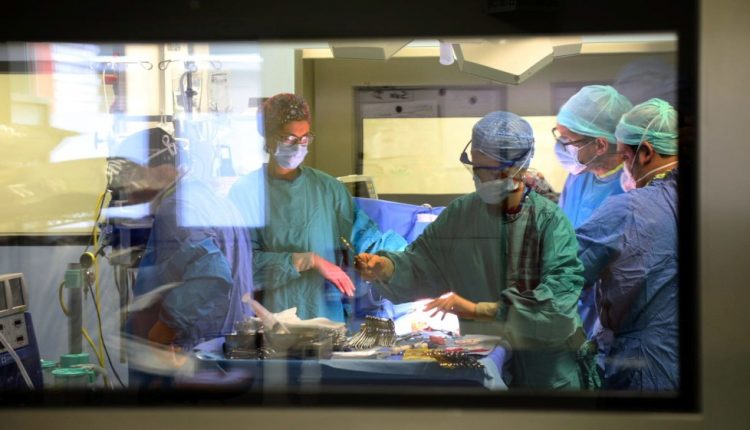
جراحة زرع الأعضاء
غالبًا ما تشير كلمة "زرع" ، بطريقة مختزلة ، إلى عملية استبدال عضو مريض بآخر سليم.
في الواقع ، هناك تنظيم كامل وإعداد كامل وراء هذه العملية يتضمن دقة فائقة وتزامنًا للأشخاص والأدوات.
تختلف ممارسة العملية باختلاف المتبرع: إذا كانت إزالة العضو من شخص حي ، فمن الممكن في الواقع التخطيط للعملية ؛ وهو أمر غير ممكن بشكل واضح إذا كانت الأعضاء تأتي من متبرع جثث توفي لأسباب عرضية وغير متوقعة.
بمجرد حصول اللجنة الطبية على موافقة الأسرة وإعلان حدوث الوفاة الدماغية للمتبرع المحتمل ، يبدأ تقييم بياناته: التوافق مع المستلمين المحتملين في قوائم الانتظار ، والتاريخ الطبي ، والخصائص المناعية ، وفصيلة الدم ، وما إلى ذلك.
تتطور زراعة الأعضاء عبر عدة مراحل
المرحلة 1
يتم إدخال الشخص المصاب بإصابات يمكن أن يكون متبرعًا (على سبيل المثال ، إصابة خطيرة جدًا في الرأس) في العناية المركزة.
طبيب يتحدث إلى الأسرة حول إمكانية التبرع بأعضائه ؛ إذا كانت متوفرة ، يتم تنبيه مركز التنسيق على الفور ، وهو المسؤول عن الإبلاغ عن الجهة المانحة المحتملة وتحديد المتلقي المحتمل.
وفي الوقت نفسه ، يتم تقييم بيانات المريض المتبرع: التوافق مع المتلقين المحتملين في القائمة ، والتاريخ الطبي ، والخصائص المناعية. تبدأ فترة المراقبة التي تبلغ 6 ساعات ، وهي إلزامية قبل التصديق على موت الدماغ.
المرحلة 2
تم تنشيط فريق الاستكشاف ويجب أن يكون متاحًا في وقت قصير جدًا.
يصل الأطباء عادة إلى المرفق بطائرة هليكوبتر. في هذه الأثناء ، في المستشفى حيث سيتم إجراء عملية الزرع ، يتم استدعاء المتلقي للخضوع لفحوصات مختلفة ولتقييم حالته الصحية.
كما يتم إجراء العديد من الفحوصات على الأعضاء التي سيتم التبرع بها لمنع انتقال الأمراض المعدية أو الأورام من المتبرع إلى المتلقي.
المرحلة 3
في نهاية فترة المراقبة ، إذا كانت جميع المؤشرات تشير إلى تشخيص موت دماغي لا رجعة فيه ، يمكن أن يبدأ الاستكشاف (حوالي ساعتين).
يدخل المستلم غرفة العمليات ويكون مستعدًا للعملية. يبدأ تناول الأدوية المثبطة للمناعة الآن لمنع الخلايا الليمفاوية من التعرف على العضو على أنه غريب ويسبب الرفض.
المرحلة 4
يصل العضو أخيرًا ، مغمورًا في محلول خاص لحماية خلاياه وينقل في حاوية خاصة مملوءة بالثلج لإبطاء نشاطه الخلوي.
يقوم فريق من الأطباء بإعداد المتلقي ، والآخر يهتم بتنظيف العضو المراد زراعته.
المرحلة 5
يمكن أن تبدأ عملية الزرع الآن: الأوعية الدموية متصلة ، ويتم التحكم في النزيف.
الخطوة 6
يخرج المريض من غرفة العمليات ، لكنه لا يزال تحت التخدير ، والذي سيستمر لمدة 6 إلى 8 ساعات أخرى على الأقل للسماح للعضو الجديد بالتعود على فرق درجة الحرارة بين الحاوية مع الثلج والجسم ، بالطبع للجهاز نفسه.
يظل المريض متصلاً بالجهاز حتى يتنفس.
الخطوة 7
يستيقظ المريض في وحدة العناية المركزة. إذا كانت حالته العامة جيدة ، يتم خلعه من جهاز التنفس الصناعي.
بعد حوالي 4 أيام ، يبدأ في المشي مرة أخرى وتناول الطعام.
بعد حوالي 10 أيام ، سيتمكن من مغادرة المستشفى والعيش مع عضوه الجديد.
في البداية ، سيتعين عليه العودة إلى المستشفى كل يوم لإجراء الفحوصات المناعية ؛ بعد عام ، سيتمكن من العودة مرة كل شهرين.
إزالة الأعضاء
بمجرد التأكد من الموت الدماغي والحصول على موافقة الأسرة (في حالة عدم وجود رغبات صريحة من المتبرعين) ، لا يتم مساعدة المتبرع المحتمل بواسطة جهاز التنفس الصناعي ويمكن حصاد الأعضاء للزرع في نفس المستشفى التي أثبتت ملاءمتها .
يدخل الفريق الذي تم تنبيهه مسبقًا إلى غرفة العمليات لإجراء عملية الإزالة.
معارضة الإزالة لا تعني أبدًا مساعدة المريض في الحصول على رعاية أفضل ؛ الرعاية ، في الواقع ، تنتهي لحظة تأسيس الموت الدماغي ؛ لذلك فإن معارضة ذلك لا تعني إلا حرمان شخص آخر من حياة أفضل بفضل عضو جديد.
اليوم ، هناك نوع آخر من الزرع يكتسب أرضية ، أي من الأشخاص الأحياء.
في الواقع ، من الممكن الآن أخذ شحمة الكلى أو الكبد أو الرئة للزرع في الأشخاص المعرضين للخطر بشكل خاص والذين لن يعيشوا في قائمة الانتظار.
عادة ما يكون هؤلاء من الأطفال ، بسبب نقص أعضاء الأطفال المزروعة وبسبب صغر حجمهم ، مما يعني أيضًا أن المتبرع لا يواجه مخاطر كبيرة.
بمجرد أخذ الأعضاء ، تتطلب إجراءات خاصة للحفاظ عليها للزرع.
لكل عضو فترة حفظ قصوى ، وبعدها تدخل الأنسجة ، التي لم تعد تستقبل الدم ، وبالتالي الأكسجين ، في النخر ، أي تموت خلاياها ، وبالتالي تصبح غير صالحة للاستعمال.
تختلف هذه الأوقات من عضو إلى آخر: القلب (4-6 ساعات) ، الرئة (4-6 ساعات) ، الكبد (12-18 ساعة) ، الكلى 48-72 ساعة ، البنكرياس (12-24 ساعة).
زرع الأعضاء: الرفض
الرفض هو رد فعل الكائن المتلقي تجاه العضو أو الأنسجة المزروعة.
في الواقع ، يتعرف الجهاز المناعي للمتلقي على العضو على أنه غريب ويهاجمه كما لو كان أحد مسببات الأمراض.
هناك أربعة أنواع من الرفض
- الرفض المفرط الحاد: هذا هو الأسرع ويحدث في غضون بضع دقائق أو ساعات بعد الزرع ؛
- الرفض المتسارع: يحدث غالبًا في المرضى الذين تلقوا بالفعل عملية زرع سابقة ويحدث بعد 3-4 أيام من العملية ؛
- الرفض الحاد: يحدث بعد فترة زمنية تتراوح من 5 إلى 90 يومًا ؛ الأعراض المحددة هي الوذمة والحمى وفقدان وظيفة العضو المزروع ؛
- الرفض المزمن: يتطور بعد حوالي 3 أشهر من الزرع ويمكن أن يتسبب في تلف الأنسجة للعضو الجديد لدرجة فقدان الوظيفة.
التعرض لرفض العضو المزروع لا يعني بالضرورة فقدانه حتمًا ؛ على العكس من ذلك ، يتم علاج الرفض بنجاح إذا تم اتخاذ الإجراء في غضون فترة زمنية معقولة من خلال استخدام الأدوية المثبطة للمناعة.
تساعد مثبطات المناعة التي يصفها الطبيب بعد الزرع العضو المزروع على عدم التعرض لخطر الرفض والبقاء بصحة جيدة.
نظرًا لاختلاف خلايا الجهاز المناعي ، فإن الأدوية الموصوفة لكبت المناعة ستكون مختلفة أيضًا.
مؤشرات وموانع لزرع الأعضاء
أكبر مؤشر فوري للزرع هو فشل لا رجعة فيه للأعضاء الحيوية مثل الكلى والكبد والرئتين والبنكرياس ، وكذلك القرنية ونخاع العظام والأمعاء.
في الواقع ، في هذه الحالات ، يكون الزرع هو العلاج الوحيد الفعال لضمان البقاء على قيد الحياة.
لذلك ، فإن أي حالة مرضية تمنع العضو من العمل بطريقة تهدد بقاء المريض تعتبر مؤشرًا على الزرع.
رعاية ما بعد الجراحة
بعد الزرع ، يتم قبول المتلقين في الأيام القليلة الأولى في جناح مجهز للعناية المركزة ، حيث يبدأ العلاج المثبط للمناعة.
يحتاج المريض الذي يعاني من نقص المناعة إلى عزل في غرف "معقمة" ، تم إنشاؤها خصيصًا لتجنب التلوث من أي نوع من البيئة الخارجية.
يتم عزل "الصندوق" الذي يدخل فيه المتلقي بعد عملية الزرع تمامًا عن بقية وحدة الإنعاش المستخدمة في الجراحة التقليدية.
تستمر حالة العزلة الصارمة طالما أن المريض يحتاج للتغلب على مرحلة ما بعد الجراحة الحرجة (عادة 5-6 أيام) ، أو في الحالات التي تتطلب العلاج المضاد للرفض.
زيارات مرضى الزراعة
في فترة ما بعد الجراحة مباشرة ، يُسمح بزيارة الأقارب المقربين طالما أنهم يرتدون ملابس مناسبة (وفقًا لإجراءات دخول الغرفة النظيفة).
يتم قبول كل شخص في منطقة التصفية واحدًا تلو الآخر ، وبالطبع قد لا يتم قبول الأشخاص المشتبه بهم و / أو الأدلة على وجود أمراض معدية.
التطورات المستقبلية
إن أخطر المشكلات في طب الزراعة هي ، من ناحية ، رفض العضو المزروع ، ومن ناحية أخرى ، عدم كفاية الأعضاء المتبرع بها مقارنة بتلك اللازمة.
في كلا الاتجاهين ، يقوم البحث بتجربة حلول مختلفة للتغلب على هذه المشاكل.
فيما يتعلق بالرفض ، تُبذل محاولات لإيجاد حلول تنجح في خداع جهاز المناعة ، وبالتالي تقليل العلاج المثبط للمناعة المستخدم حاليًا ، أو التي تحمي العضو المزروع من هجوم الخلايا اللمفاوية التائية المسؤولة عن القضاء على العوامل خارج الجسم .
من ناحية أخرى ، يتم اختبار نقص الأعضاء أو الأعضاء الاصطناعية أو هندسة الأنسجة أو زرع الأعضاء التي يمكن أن تحل محل الأعضاء البشرية.
العلاج الجيني
من خلال العلاج الجيني ، من الممكن الذهاب إلى مصدر المشكلة والقضاء على العيوب الجينية مباشرة في الخلايا أو الأنسجة أو الأعضاء المصابة.
يتم إدخال الجين السليم مباشرة في المنطقة المصابة ، حيث يبدأ في إنتاج تلك المواد التي لا يستطيع الجسم المصاب إنتاجها بمفرده.
ومع ذلك ، لا يزال العلاج الجيني بعيدًا عن الاستخدام. من أجل التمكن من نقل الحمض النووي الغريب إلى نواة الخلية ، هناك حاجة إلى "نواقل" خاصة - فيروسات فقدت خصائصها المعدية ، لكنها لا تزال قادرة على مهاجمة الخلايا ونقل تراثها الجيني إليها.
لتجنب الرفض ، يجب معالجة العضو المراد زراعته في المختبر ، ونقل الجينات إليه التي تجعله قادرًا على الدفاع عن نفسه ضد الجهاز المناعي للمتلقي.
الآن الجينات معروفة ، لكن لم يتم التعامل معها بعد بالدقة اللازمة. ستكون الخطوة التالية هي البحث عن مزيج مثالي من الجينات التي تمنع عمل جميع الآليات المناعية للمتلقي.
هندسة الانسجة
الهدف من هذا النوع من العلاج هو إيجاد بديل للأعضاء البشرية.
الآن ، يستطيع الباحثون إنتاج أنسجة مثل الأوعية الدموية وصمامات القلب والغضاريف والجلد في المختبر.
كان من الممكن التغلب على هذه الحدود الجديدة بفضل حقيقة أن الخلايا تميل إلى التجمع لتشكيل الأعضاء والأنسجة.
الخلايا الجذعية
الخلايا الجذعية هي الخلايا غير المتمايزة الموجودة في الأجنة البشرية بعد أسبوع من الإخصاب.
وهي أيضًا الخلايا "البادئة" التي تتطور منها أنسجة وأعضاء الطفل المولد.
وظيفتها هي تنظيم دوران خلايا الدم (خلايا الدم الحمراء ، خلايا الدم البيضاء والصفائح الدموية) والجهاز المناعي (الخلايا الليمفاوية).
اليوم ، يتم استخدام الآلات المحوسبة ، والفواصل ، لتجميع هذه الخلايا ، مما يسمح باختيار الخلايا اللازمة. متلقي الخلايا هم مرضى يعانون من أمراض جلدية أو أمراض دم أو أورام صلبة.
بالإضافة إلى حقيقة أن الخلايا الجذعية لا تزال غير معروفة إلى حد كبير ، هناك أيضًا مشكلة أخلاقية: حصاد الخلايا الجذعية الجنينية يعني موت الجنين.
هذا هو السبب في أن طريقة حصاد الخلايا الجذعية من البالغين يتم إتقانها.
استنساخ
ستجعل تقنية الاستنساخ من الممكن التحايل على مشكلة رفض العضو تمامًا.
قد ينطوي على إدخال نواة خلية المريض ، بكل تراثها الجيني ، في الخلية الجذعية لجنين بشري أو بويضة لم يكن لها في السابق نواة خاصة بها.
تزرع هذه الخلايا المعدلة في المختبر في المختبر ، وتكون متطابقة وراثيًا مع تلك الموجودة في الجهاز المناعي للمريض ، والذي لن يتعرف عليها على أنها أجنبية.
هذه التقنية ليست خيارًا قابلاً للتطبيق في الوقت الحالي لأن كل من الاستنساخ وحصاد الخلايا الجذعية والاستخدام العشوائي للبويضات محظور بموجب القانون.
زرع الأعضاء
يبدو أن الزرع Xenotransplantation ، أي زرع الخلايا والأنسجة والأعضاء الحيوانية في البشر ، هو الحل المستقبلي لنقص الأعضاء للزراعة.
التجارب في هذا المجال عديدة وتواجه مشاكل أخلاقية ونفسية ، وأخيراً وليس آخراً ، مشاكل مناعية.
المحاولات القليلة التي تم إجراؤها ، في الواقع (زرع كبد خنزير وقلب بابون في شخصين مختلفين) لم تسفر عن النتائج المرجوة.
في الواقع ، كانت أزمة الرفض عنيفة بشكل خاص ومن المستحيل السيطرة عليها.
ومع ذلك ، يمكن أن تكون هذه التقنية حقاً حلاً لنقص الأعضاء.
في الواقع ، أكثر ما يخشاه هو تطور عدوى حيوانية نموذجية ، تنتقل إلى البشر عن طريق مسببات الأمراض الموجودة في العضو المراد زرعه ، والتي يمكن أن تكون كارثية.
يمكن أن يكون البديل المحتمل لهذا الإعاقة هو التعديلات الجينية على الحيوانات المانحة. في الممارسة العملية ، سيتم تربية الحيوانات في بيئة معقمة ويتم تعديلها وراثيًا لجعل أعضائها أكثر توافقًا مع كائن المتلقي.
ومع ذلك ، فقد تم تحقيق بعض المعالم في الوقت الحالي ؛ هذه هي عمليات زرع الخلايا للأعضاء وليست عمليات زرع الأعضاء ، مثل خلايا أجنة الخنازير لعلاج مرض باركنسون ، وخلايا نخاع البابون المزروعة في مرضى الإيدز المصابين بأمراض عضال في محاولة لاستعادة الجهاز المناعي للمرضى ، أو أنسولا البنكرياس لا تزال من الخنازير في التحفيز من إنتاج الأنسولين كعلاج لمرض السكري.
زرع الأعضاء: الأعضاء الاصطناعية
حل آخر لفشل الأعضاء مثل الرفض هو الأعضاء الاصطناعية.
المشكلة الرئيسية هي التوافق البيولوجي. فهذه ، بعد كل شيء ، أعضاء ميكانيكية يجب أن تتكيف مع كائن حيوي.
يجب أن يغطي التوافق الحيوي جميع الخصائص المورفولوجية والفيزيائية والكيميائية والوظيفية القادرة على توفير وظائف العضو ، وفي الوقت نفسه ، بقائه دون التعرض لخطر الرفض.
كل هذه الآثار هي التي تجعل إنتاج الأعضاء الاصطناعية قادرة على استبدال الأعضاء "الطبيعية" بشكل كامل ومثالي في وظائفها.
اقرأ أيضا:
زراعة الأعضاء: التشخيص والعناية بالمرضى المنتظرين
الإرشادات الأولى لاستخدام ECMO في مرضى الأطفال الذين يخضعون لزراعة الخلايا الجذعية المكونة للدم
كيف تتم عملية زراعة الوجه؟ - فيديو
الذكاء الاصطناعي الموفر للقلب: يظهر نظام الذكاء الاصطناعي وعودًا في تحديد علامات رفض زراعة القلب
فشل القلب والذكاء الاصطناعي: خوارزمية التعلم الذاتي لكشف العلامات غير المرئية لتخطيط القلب



