Blocco dei vaccini anti-influenzali, come individuarli e come saranno smaltiti?
Chi ha in casa il farmaco dei lotti 142701 e 143301 deve riconsegnarlo ai medici di famiglia, in alternativa in ospedale. Intanto le somministrazioni sono state sospese in Liguria, Molise e nell’area milanese
Due lotti del vaccino antinfluenzale FLAUD sono in fase di ritiro dal mercato dopo la morte di tre persone che hanno assunto il farmaco. Il caso è esploso ieri sera a seguito delle segnalazioni avvenute in Sicilia e in Molise. Il comunicato dell’Agenzia Italiana del Farmaco è chiaro:
“A seguito delle segnalazioni di quattro eventi avversi gravi o fatali, verificatisi in concomitanza temporale con la somministrazione di dosi provenienti dai due lotti 142701 e 143301 del vaccino antinfluenzale FLUAD della Novartis, in attesa di disporre degli elementi necessari, tra i quali l’esito degli accertamenti sui campioni già prelevati, per valutare un eventuale nesso di causalità con la somministrazione delle dosi dei due lotti del vaccino, l’Agenzia Italiana del Farmaco (AIFA) ha disposto, a titolo esclusivamente cautelativo, il divieto di utilizzo di tali lotti. L’AIFA invita i pazienti che abbiano in casa confezioni del vaccino FLUAD a verificare sulla confezione il numero di lotto e, se corrispondente a uno di quelli per i quali è stato disposto il divieto di utilizzo, a contattare il proprio medico per la valutazione di un’alternativa vaccinale”.
COME IDENTIFICARE IL LOTTO DEL FARMACO? – Chi è in possesso del farmaco FLAUD deve controllare il numero di lotto sul fondo della confezione. La necessità di identificare le singole confezioni di farmaci lungo il loro iter all’interno dell’azienda ospedaliera nasce principalmente dal bisogno di poter tenere traccia di tutti i medicinali che percorrono la catena che va dalla prescrizione alla somministrazione degli stessi, passando dallo stoccaggio nella farmacia ospedaliera e nei reparti. Tale necessità è simile a quella che si manifesta anche a monte della catena, ovvero dai produttori ai distributori e ai grossisti, fino ad arrivare ai consumatori, in particolare farmacie ed aziende ospedaliere.
Le criticità cui si intende sopperire attraverso una corretta identificazione del farmaco sono molteplici, tra di esse:
- la volontà di somministrare al paziente il farmaco controllando dose, scadenza e naturalmente;
- la possibilità di un controllo sulla situazione inventariale ed una conseguente riduzione delle quantità stoccate, quindi un vantaggio economico;
- la possibilità di rintracciare i lotti di produzione, in caso di ritiro dal mercato, ovunque essi si trovino in azienda.
Fino ad oggi, laddove le strutture hanno avviato progetti di tracciabilità dei farmaci, si è provveduto all’identificazione delle confezioni sia tramite la lettura del codice ministeriale che tramite l’utilizzo di un numero seriale interno all’azienda. Tale numero viene generato al momento dell’inserimento dei dati sulla confezione nel database aziendale. I dati inseriti devono contenere almeno le seguenti informazioni per modo da garantire la tracciabilità totale della confezione.
- nome commerciale del farmaco
- lotto
- data di scadenza
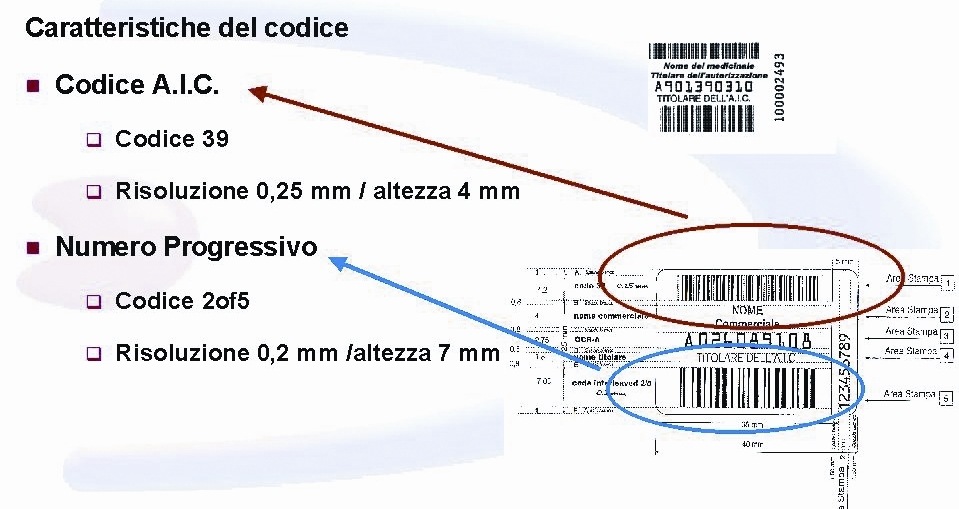
Il 15 Luglio 2004, il ministro della Sanità ha istituito, per mezzo di un decreto, presso il Ministero della Salute una banca dati centrale che, partendo dai dati di produzione e fornitura dei bollini numerati dei medicinali, raccoglie e registra i movimenti delle singole confezioni dei prodotti medicinali. Tali bollini numerati, presenti sulle confezioni di medicinali erogati dal SSN, vengono prodotti dall’Istituto Poligrafico e Zecca dello Stato, e contengono informazioni riguardanti la specifica confezione. In particolare sono costituiti da:
un numero identificativo della confezione (ovvero il codice di autorizzazione all’immissione in commercio, AIC) riportato sul bollino in codice a barre di tipo 39;
un numero progressivo della singola confezione riportato sul bollino in codice a barre di tipo 2/5;
il numero progressivo della singola confezione riportato in chiaro e apposto sul secondo strato del bollino, in caso di rimozione del codice a barre.
IL FARMACO RITIRATO VERRA’ BRUCIATO? – Non subito. La procedura di smaltimento del farmaco è chiara e prevede lo smaltimento tramite “termodistruzione” del prodotto. I farmaci sono prodotti chimici di sintesi sulle cui confezioni compare sempre una data di scadenza. Trascorso il termine ultimo indicato dalla casa farmaceutica, i medicinali non sono più utilizzabili e devono essere smaltiti correttamente. La parte del prodotto pericolosa è quella costituita dai principi attivi. In discarica, mischiati alla spazzatura domestica, possono dar luogo ad emanazioni tossiche e possono inquinare il percolato (il liquido che si accumula sul fondo della discarica). E’ per questo motivo che i farmaci scaduti non devono essere gettati nei normali cassonetti, ma collocati negli appositi contenitori presso le farmacie e le isole ecologiche. Lo smaltimento dei farmaci scaduti avviene attraverso la termodistruzione, oppure attraverso la loro inertizzazione in contenitori ermetici. In Italia avviene soprattutto la prima pratica, che dovrebbero seguire anche i vaccini dei due lotti FLAUD incriminati.
IL VACCINO E’ PERICOLOSO? – No, il vaccino antinfluenzale non è pericoloso. L’Agenzia Italiana del Farmaco ricorda che i vaccini sono una risorsa preziosa e insostituibile per la prevenzione dell’influenza stagionale e delle sue complicanze, che possono dare luogo a casi di intensità severa e colpiscono con frequenza maggiore in particolare gli ultrasessantacinquenni e i pazienti affetti da condizioni croniche preesistenti. AIFA sottolinea che il provvedimento emanato oggi, che dispone il divieto di utilizzo di due lotti del medicinale FLUAD, è stato assunto a scopo esclusivamente cautelativo, a seguito di segnalazioni pervenute all’Agenzia dalla Rete nazionale di farmacovigilanza. Nei casi in questione sono state riportate reazioni avverse, successivamente alla somministrazione del vaccino e in tre casi si sono verificati dei decessi, ma al momento non è certo se si tratti di una casualità oppure se vi sia un nesso con la vaccinazione.
Un quadro completo potrà essere fornito solo dopo aver analizzato tutti gli elementi di contesto, tra i quali, ad esempio, lo stato di salute dei pazienti, la loro età ed eventuali patologie da cui erano affetti. AIFA rinnova in ogni caso l’invito a chi si fosse sottoposto a vaccinazione con uno dei lotti oggetto del divieto di utilizzo a contattare il proprio medico curante. L’AIFA specifica inoltre che i tre eventi ad esito fatale hanno avuto esordio entro le 48 ore dalla somministrazione delle dosi dei due lotti del vaccino.
FONTI: AIFA – FEDERFARMA ROMA – LOGISTICA DEL FARMACO – MINISTERO DELLA SALUTE



