Drenaggio della gamba in un paziente pediatrico traumatizzato: case report su bambino di 7 anni
Il drenaggio della gamba di un paziente pediatrico è l’oggetto di un interessante case report su un bambino di 7 anni ferito in un incidente automobilistico
Drenaggio in un paziente pediatrico traumatizzato, presentazione del case report
Un maschio di 7 anni con una storia medica pregressa di asma ha subito lesioni multiple in un incidente automobilistico tra cui una lussazione dell’anca sinistra, una frattura del femore sinistro, una frattura radiale sinistra, una frattura comminuta della parete laterale dell’orbita destra, un emorragia retrobulbare e frattura non scomposta della parete posteriore del seno mascellare destro.
Ha subito una riduzione chiusa della lussazione dell’anca sinistra, fissazione esterna della frattura del femore sinistro e riduzione chiusa e colata della frattura del radio sinistro con rimozione del fissatore esterno e placcatura sottomuscolare del femore sinistro 7 giorni dopo.
Inizialmente era perso al follow-up fino a quando un’infermiera in visita, che si prendeva cura di sua madre, notò che la ferita del femore sinistro stava drenando.
Il resto del suo esame fisico era normale ed è stato ricoverato in ospedale per ulteriori accertamenti.
La raccolta purulenta è stata aspirata ed è risultata infine coltura negativa.
Una radiografia del femore sinistro mostrava calli esuberanti nei siti di frattura.
I suoi segni vitali includevano una temperatura di 36,9 °C, polso di 118 battiti/min, pressione sanguigna di 105/47 mm Hg, frequenza respiratoria di 20 respiri/min e saturazione di ossigeno del 100% nell’aria ambiente.
Gli studi di laboratorio al momento del ricovero sono stati: conta leucocitaria di 14,9 × 1000/μL (intervallo di riferimento 4,0-15,0 × 1000/μL) con neutrofili del 69,9% (intervallo di riferimento 26,0%-77,0%), 17,3% linfociti (intervallo di riferimento 12,0% –60,0%), monociti 8,9% (intervallo di riferimento 3,0%–14,0%), eosinofili 3% (intervallo di riferimento 0,0%–10,0%), basofili 0,2% (intervallo di riferimento 0,0%–4,0%) e granulociti immaturi 0,7% (intervallo di riferimento intervallo 0,0%-3. 0%), proteina C-reattiva (CRP) ad alta sensibilità di 39 mg/L (intervallo di riferimento <1,0 mg/L) e velocità di eritrosedimentazione (VES) di 78 mm/h (intervallo di riferimento 0-20 mm/h) .
Il giorno successivo è stato portato in sala operatoria (OR) dove sono state identificate 2 aree di pus all’interno dell’incisione più distale e un tracciato del tratto sinusale dietro il femore e sulla placca metallica precedentemente posizionata.
L’area è stata lavata, e gli è stata somministrata l’oxacillina.
Le colture batteriche aerobiche e anaerobiche sono risultate negative ad eccezione di 2 diversi isolati di stafilococco coagulasi-negativo che non sono stati recuperati dalle piastre ma sono cresciuti solo dal brodo tioglicolato dopo 4 giorni, suggerendo bassi livelli di batteri.
Il paziente passato da oxacillina a vancomicina 15 mg/kg/dose ogni 8 ore, ottenendo un livello minimo iniziale di 6,8 μg/mL.
Quando il suo gesso è stato rimosso 5 giorni dopo l’intervento, è stata notata una nuova raccolta purulenta superficiale nel femore laterale medio sinistro che ha richiesto un altro lavaggio.
Ha continuato con vancomicina, che era stata aggiustata a 15 mg/kg/dose ogni 6 ore, per mantenere valori minimi tra 15 e 20 µg/mL, con un livello massimo di 19,6 µg/mL.
Paziente pediatrico di 7 anni: ventidue giorni dopo, le suture sono state rimosse e ancora una volta è stato trovato un drenaggio purulento nei siti di incisione inferiore e media della coscia laterale sinistra
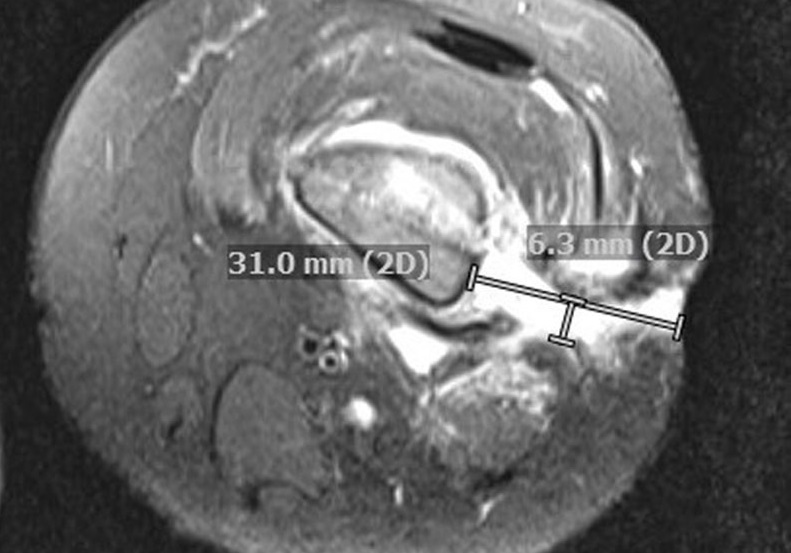
La risonanza magnetica (MRI) ha mostrato diversi tratti sottili che si estendono dal femore alla pelle oltre ad aree diffuse di midollo osseo, tessuti molli adiacenti ed edema muscolare, nonché reazione periostale cronica ( è stata notata una nuova raccolta superficiale purulenta nel femore laterale medio sinistro che ha richiesto un altro washout.
Ha continuato con vancomicina, che era stata aggiustata a 15 mg/kg/dose ogni 6 ore, per mantenere valori minimi tra 15 e 20 µg/mL, con un livello massimo di 19,6 µg/mL.
La risonanza magnetica (MRI) ha mostrato diversi tratti sottili che si estendono dal femore alla pelle oltre ad aree diffuse di midollo osseo, tessuti molli adiacenti ed edema muscolare, nonché reazione periostale cronica.
È interessante notare che i suoi marker infiammatori erano tutti diminuiti (CRP 5,3 mg/L, VES 25 mm/h e GB 8,4 × 1000/μL). Le colture prese durante la terza incisione e il drenaggio in sala operatoria hanno rivelato la diagnosi.
Centocinquantadue giorni dopo l’iniziale MVA traumatica, il paziente è stato sottoposto a una terza incisione e drenaggio dove è stato trovato pus nei siti di incisione originali e sotto la banda ileotibiale e le porzioni del vasto laterale che richiedevano lo sbrigliamento.
Diverse biopsie ossee e colture di liquido purulento dall’osso sono state raccolte per la colorazione e la coltura.
Le macchie erano negative per batteri, funghi e bacilli acido-resistenti.
In una delle 3 colture di pus sono cresciute 3 unità formanti colonie di Clostridioides difficiledopo incubazione anaerobica per 3 giorni.
Questo è stato identificato dalla spettrometria di massa a tempo di volo di desorbimento/ionizzazione assistita da matrice laser utilizzando il database diagnostico in vitro di spettrometria di massa Vitek (bioMérieux).
Le colture di bacilli batterici, fungini e acido-resistenti dell’osso sono rimaste sterili e un test molecolare per i micobatteri non tubercolari è risultato negativo.
Le biopsie ossee del femore distale e medio sinistro hanno mostrato osteomielite cronica.
Ripetere la risonanza magnetica 7 giorni dopo, ha rivelato un aumento della regione non stimolante all’interno del midollo femorale distale riguardante materiale necrotico rispetto a quello purulento, che comunicava con un tratto che migliorava il fluido verso la pelle e un frammento di osso corticale sequestrato nel femore medio-distale.
Nonostante il trattamento continuato con vancomicina IV, i suoi marker infiammatori sono aumentati: WBC 10,9 × 1000/μL, CRP 42. 8 mg/L e VES 59 mm/h.
Tornato in sala operatoria, un tratto sinusale nell’aspetto distale dell’incisione superiore è stato sbrigliato e si è notato che il pus si stava dirigendo verso un ascesso sottoperiostale.
Il metronidazolo empirico è stato avviato a causa della precedente coltura positiva perC. difficile e la vancomicina è stata continuata.
Tre delle 4 colture di tessuti sono cresciute C. difficile, dopo incubazione anaerobica.
La vancomicina è stata interrotta per mancanza di miglioramento dopo 6 settimane di terapia.
Una risonanza magnetica di follow-up del femore sinistro 21 giorni dopo l’ultimo intervento di sala operatoria ha dimostrato nuovamente l’osteomielite cronica con tratti fistolosi drenanti persistenti ma senza progressione o nuovi risultati.
I suoi marker infiammatori erano: WBC 6,2 × 1000/μL, CRP 0,3 mg/L e ESR 8 mm/h.
Ha completato 3 settimane di terapia con metronidazolo IV ed è passato alla terapia orale 188 giorni dopo la lesione iniziale.
Rimane in terapia con metronidazolo orale per osteomielite cronica.
Alla sua ultima visita di controllo, il suo esame fisico era significativo per nessun ulteriore drenaggio purulento dalle incisioni laterali della coscia
Ha continuato ad avere una VES leggermente elevata di 25 mm/h, ma una PCR normale di 0,3 mg/L.
L’ infezione extra-intestinale da C. difficile è una manifestazione rara di un comune microrganismo acquisito in ospedale. 1–2
Ci sono 5 serie di casi che descrivono l’ infezione extra-intestinale da C. difficile dal 1962 e 1 rapporto a seguito di un trapianto di microbiota fecale. 2-8
Due di queste serie di casi condotte da Mattila et al 3 e Gupta et al 4 su periodi di 10 anni hanno identificato che l’ infezione da C. difficile extra-intestinale rappresentava rispettivamente lo 0,17% e lo 0,61% di tutto il C. difficile.
Queste serie di casi includevano pazienti con batteriemia, infezioni addominopelviche più comunemente a seguito di un’interruzione della parete del colon, infezioni postoperatorie, infezioni della ferita, osteomielite, infezioni delle protesi articolari, ascessi splenici, un ascesso cerebrale, infezione polmonare e isolamento dell’organismo dal liquido pericardico . 2–7 , 9
Sono stati segnalati tredici casi precedenti di infezioni ossee e articolari da C. difficile , inclusi 6 bambini. 2-4 , 7 osteoarticolari infezioni sono stati associati con l’hardware, traumi o patologie concomitanti di malignità o emoglobinopatie.
Sei dei 10 case report includevano hardware ortopedico. 2 È possibile che queste siano avvenute per batteriemia con semina batterica; tuttavia, è anche possibile che le incisioni chirurgiche siano state contaminate da feci.
Più comunemente, C. difficile è stato isolato da colture polimicrobiche; tuttavia, alcuni pazienti hanno avuto una crescita pura della coltura di C. difficile . 2–5 , 7
Le colture aerobi e anaerobiche iniziali del nostro paziente erano negative con crescita di stafilococco coagulasi-negativo dal brodo tioglicolato, suggerendo un basso numero di batteri; tuttavia, 2 ulteriori set separati di colture chirurgiche aerobiche e anaerobiche hanno prodotto solo colture anaerobiche positive per C. difficile .
C. difficile è stato segnalato in pazienti traumatizzati che erano precedentemente sani e hanno sviluppato infezioni profonde della ferita, fascite e cancrena gassosa, a sostegno del fatto che C. difficile può essere un agente patogeno aggressivo nelle infezioni della ferita. 3
La revisione dei casi di C. difficile extraintestinale mostra che una caratteristica comune è l’ospedalizzazione e la ricezione di antibiotici, fattori di rischio noti per la colonizzazione di C. difficile . 3-5
La maggior parte dei pazienti non aveva sintomi clinici di diarrea, ma tutti avevano comorbilità come precedenti interventi chirurgici, come questo paziente. 3-5 , 7
Quasi tutti i pazienti hanno ricevuto un regime che includono metronidazolo in combinazione con vancomicina o un altro antibiotico. 2 , 4 , 5
Degno di nota, il nostro paziente è stato inizialmente avviato alla vancomicina, ma ha richiesto molteplici sbrigliamenti chirurgici e l’inizio del metronidazolo IV prima che si osservasse un miglioramento clinico.
Persistent_Leg_Drainage_in_a_Pediatric_Trauma.27 drenaggio traumatizzato pediatricoPer approfondire:
Accesso venoso, 20 consigli utili per non sbagliare una vena
Il drenaggio toracico in emergenza sanitaria
Fonte dell’articolo:
Drenaggio persistente delle gambe in un paziente traumatizzato pediatrico
Howard, Ashley FANNO * ; Rychalsky, Michelle R. PharmD † ; Murray, Thomas S. MD, PhD *
The Pediatric Infectious Disease Journal: giugno 2021 – Volume 40 – Numero 6 – p 597-599
doi: 10.1097/INF.0000000000003004
RIFERIMENTI
- McDonald LC, Gerding DN, Johnson S, et al. Linee guida di pratica clinica per l’ infezione da Clostridium difficile negli adulti e nei bambini: aggiornamento 2017 da parte della Infectious Diseases Society of America (IDSA) e della Society for Healthcare Epidemiology of America (SHEA). Clin Infect Dis. 2018;66: e1–e48.
- Al-Najjar A, Al-Rawahi GN, Hoang LM, et al. Osteomielite vertebrale da Clostridium difficile . Pediatr Infect Dis J. 2013;32:1030-1032.
- Mattila E, Arkkila P, Mattila PS, et al. Infezioni extraintestinali da Clostridium difficile . Clin Infect Dis. 2013;57:e148–e153.
- Gupta A, Patel R, Baddour LM, et al. Infezioni extraintestinali da Clostridium difficile : un’esperienza a centro singolo. Mayo Clin Proc. 2014;89:1525–1536.
- Wolf LE, Gorbach SL, Granowitz EV. Clostridium difficile extraintestinale : 10 anni di esperienza in un ospedale terziario. Mayo Clin Proc. 1998;73:943-947.
- Byl B, Jacobs F, Struelens MJ, et al. Infezioni extraintestinali da Clostridium difficile . Clin Infect Dis. 1996;22:712.
- García-Lechuz JM, Hernangómez S, Juan RS, et al. Infezioni extra-intestinali causate da Clostridium difficile . Clin microbiol infettare. 2001; 7:453-457.
- Gardiner BJ, Thorpe CM, Pinkham NV, et al. Un recidivo: infezione da Clostridium difficile extraintestinale ricorrente a seguito di trapianto di microbiota fecale. Anaerobi. 2018;51:68–72.
Mohamed A, Sostre V, Patel H, et al. Clostridium difficile che causa empiema. Case Rep Gastroenterolo. 2018;12:633–639.
- Canzone PH, Min JH, Kim YS, et al. Diagnosi rapida e accurata dell’infezione da Clostridium difficile mediante reazione a catena della polimerasi in tempo reale. Intesto Ris. 2018;16:109–115.
- Peng Z, Jin D, Kim HB, et al. Aggiornamento sulla resistenza antimicrobica in Clostridium difficile : meccanismi di resistenza e test di suscettibilità agli antimicrobici. J Clin Microbiol. 2017;55:1998–2008.
- Landersdorfer CB, Bulitta JB, Kinzig M, et al. Penetrazione di antibatterici nell’osso: considerazioni farmacocinetiche, farmacodinamiche e bioanalitiche. Clin farmacocinetica. 2009; 48: 89-124.



