Orgaantransplantatie: waar het uit bestaat, wat de stadia zijn en wat de toekomst in petto heeft
Orgaantransplantatie is de chirurgische ingreep waarbij een of meer zieke organen (waarvan de functionaliteit niet meer kan worden hersteld) worden vervangen door een of meer organen die zijn afgenomen van een donor (lijk of levend)
Een operatie die conceptueel zijn wortels heeft in de vroegste geschiedenis van de mensheid (er werd voor het eerst over gesproken door Chinese artsen), het is niettemin een zeer recente therapeutische oplossing: de kennis die het mogelijk maakte (immunologie, studie van antigenen...) was pas aan het begin van de 20e eeuw verworven.
Vanaf 1950 werd transplantatie een gevestigde keuze bij de behandeling van die pathologieën die leiden tot de onherstelbare vernietiging van het orgaan en dus tot de dood van de patiënt.
Maar transplantatie is niet alleen het laatste vooruitzicht voor degenen wier leven in gevaar is: deze operatie maakt het ook mogelijk om de kwaliteit van leven te verbeteren van patiënten die lijden aan chronisch invaliderende ziekten (bijvoorbeeld niertransplantatie voor gedialyseerde patiënten).
De toekomst van transplantatie moet nog worden geschetst, maar is heel duidelijk in de geest van wetenschappers en artsen die zich bezighouden met onderzoek: implantatie van kunstmatige organen of organen van genetisch gemodificeerde dieren (xenotransplantatie), klonen en implantatie van stamcellen zijn slechts enkele van de richtingen waarin het wetenschappelijke landschap van de wereld zich beweegt.
Orgaantransplantatie chirurgie
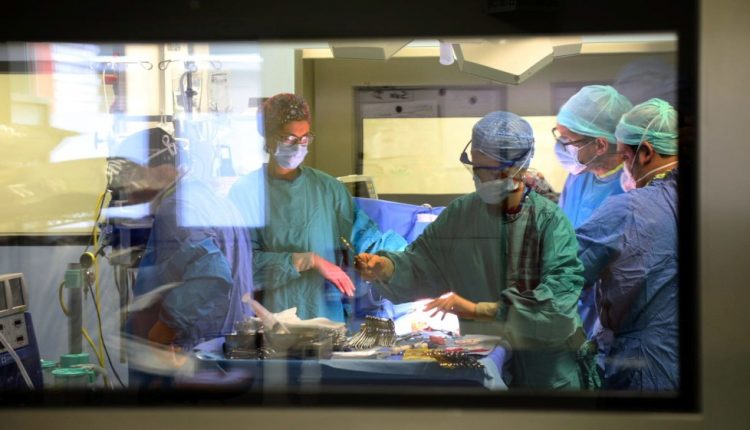
Het woord 'transplantatie' duidt vaak op een reductieve manier op de operatie van het vervangen van een ziek orgaan door een gezond orgaan.
In werkelijkheid zit er een hele organisatie en voorbereiding achter deze operatie die extreme precisie en synchronisatie van mensen en instrumenten vereist.
De praktijk van de operatie verschilt afhankelijk van de donor: als de orgaanverwijdering van een levend persoon is, is het in feite mogelijk om de operatie te plannen; wat natuurlijk niet haalbaar is als de organen afkomstig zijn van een kadaverdonor, die door een toevallige en onvoorziene oorzaak is overleden.
Zodra de medische commissie de toestemming van de familie heeft gekregen en verklaart dat de potentiële donor hersendood heeft ingetreden, begint de evaluatie van zijn gegevens: compatibiliteit met potentiële ontvangers op de wachtlijsten, medische geschiedenis, immuunkenmerken, bloedgroep, enz.
Orgaantransplantatie verloopt in verschillende stadia
FASE 1
Een persoon met verwondingen die donor kunnen zijn (bijvoorbeeld een zeer ernstig hoofdletsel) wordt opgenomen op de intensive care.
Een arts spreekt met de familie over de mogelijkheid om zijn of haar organen te doneren; als ze beschikbaar zijn, wordt het coördinatiecentrum onmiddellijk gewaarschuwd, dat verantwoordelijk is voor het melden van de potentiële donor en het identificeren van de potentiële ontvanger.
Ondertussen worden de gegevens van de donorpatiënt beoordeeld: compatibiliteit met potentiële ontvangers op de lijst, medische geschiedenis, immuunkenmerken. De observatieperiode van 6 uur begint, die verplicht is vóór de certificering van hersendood.
FASE 2
Het explantatieteam wordt geactiveerd en moet binnen zeer korte tijd beschikbaar zijn.
De artsen bereiken de faciliteit meestal per helikopter. Ondertussen wordt de ontvanger in het ziekenhuis waar de transplantatie zal worden uitgevoerd, opgeroepen om verschillende onderzoeken te ondergaan en zijn of haar gezondheidstoestand te beoordelen.
Ook op de te doneren organen worden tal van controles uitgevoerd om de overdracht van infectieziekten of tumoren van donor op ontvanger te voorkomen.
FASE 3
Als aan het einde van de observatieperiode alle indicaties wijzen op een diagnose van onomkeerbare hersendood, kan de explantatie beginnen (ongeveer 2 uur).
De ontvanger komt de operatiekamer binnen en wordt voorbereid op de operatie. De toediening van immunosuppressiva begint nu om te voorkomen dat de lymfocyten het orgaan als vreemd herkennen en afstoting veroorzaken.
FASE 4
Het orgel komt eindelijk aan, ondergedompeld in een speciale oplossing om zijn cellen te beschermen en vervoerd in een speciale container gevuld met ijs om zijn cellulaire activiteit te vertragen.
Het ene team van artsen bereidt de ontvanger voor, het andere zorgt voor de reiniging van het te transplanteren orgaan.
FASE 5
De transplantatie kan nu beginnen: de bloedvaten zijn verbonden, de bloeding is onder controle.
STAP 6
De patiënt komt uit de operatiekamer, maar is nog steeds onder narcose, wat nog zeker 6 tot 8 uur zal duren om het nieuwe orgaan te laten wennen aan het temperatuurverschil tussen de container met het ijs en het lichaam en, natuurlijk naar het orgel zelf.
De patiënt blijft verbonden met de machine om te ademen.
STAP 7
De patiënt wordt wakker op de intensive care; als zijn algemene toestand goed is, wordt hij van het beademingsapparaat gehaald.
Na ongeveer 4 dagen begint hij weer te lopen en te eten.
Na ongeveer 10 dagen zal hij het ziekenhuis kunnen verlaten en met zijn nieuwe orgel kunnen leven.
In eerste instantie zal hij elke dag terug moeten naar het ziekenhuis voor immunologische controles; na een jaar kan hij eens in de twee maanden terugkeren.
orgaanverwijdering
Zodra hersendood is vastgesteld en toestemming van de familie is verkregen (bij gebrek aan expliciete donorwensen), wordt de potentiële donor niet langer bijgestaan door het mechanische beademingsapparaat en kunnen de organen worden geoogst voor transplantatie in hetzelfde ziekenhuis dat geschikt is bevonden .
Het eerder gealarmeerde team komt de operatiekamer binnen voor de verwijderingsoperatie.
Tegen de verwijdering zijn betekent nooit dat de patiënt betere zorg krijgt; zorg eindigt in feite op het moment dat hersendood is vastgesteld; zich ertegen verzetten zou dus alleen maar betekenen dat je een ander een beter leven ontneemt dankzij een nieuw orgaan.
Tegenwoordig wint ook een ander type transplantatie terrein, die van levende mensen.
Het is nu inderdaad mogelijk om een nier-, lever- of longkwab te nemen voor transplantatie bij bijzonder risicopatiënten die niet op de wachtlijst zouden overleven.
Dit zijn meestal kinderen, zowel vanwege het tekort aan pediatrische transplantatieorganen als vanwege de kleine omvang, waardoor de donor ook geen al te groot risico loopt.
Eenmaal genomen, vereisen organen speciale procedures om ze te bewaren voor transplantatie.
Er is voor elk orgaan een maximale bewaartijd, waarna de weefsels, die geen bloed en dus zuurstof meer ontvangen, in necrose gaan, dwz hun cellen sterven en zijn daarom onbruikbaar.
Deze tijden variëren van orgaan tot orgaan: hart (4-6 uur), long (4-6 uur), lever (12-18 uur), nier 48-72 uur, pancreas (12-24 uur).
Orgaantransplantatie: afstoting
Afstoting is de reactie die het ontvangende organisme heeft op het getransplanteerde orgaan of weefsel.
In feite herkent het immuunsysteem van de ontvanger het orgaan als vreemd en valt het aan alsof het een ziekteverwekker is.
Er zijn vier soorten afwijzing:
- hyperacute afstoting: dit is het snelst en treedt op binnen enkele minuten of uren na transplantatie;
- versnelde afstoting: komt vaak voor bij patiënten die al eerder een transplantatie hebben ondergaan en treedt 3-4 dagen na de operatie op;
- acute afstoting: treedt op na een periode van 5 tot 90 dagen; specifieke symptomen zijn oedeem, koorts en functieverlies van het getransplanteerde orgaan;
- chronische afstoting: ontwikkelt zich ongeveer 3 maanden na transplantatie en kan weefselschade aan het nieuwe orgaan veroorzaken tot functieverlies.
Het ervaren van afstoting van het getransplanteerde orgaan betekent niet noodzakelijkerwijs het verlies ervan; integendeel, afstoting wordt met succes behandeld als er binnen een redelijke termijn actie wordt ondernomen door middel van immunosuppressiva.
De immunosuppressiva die de arts na de transplantatie voorschrijft, zullen het getransplanteerde orgaan helpen om afstoting niet te riskeren en gezond te blijven.
Omdat de cellen van het immuunsysteem anders zijn, zullen de medicijnen die worden voorgeschreven voor immunosuppressie ook anders zijn.
Indicaties en contra-indicaties voor orgaantransplantatie
De grootste en meest directe indicatie voor transplantatie is onomkeerbaar falen van vitale organen zoals nieren, lever, longen, pancreas, maar ook hoornvliezen, beenmerg, darmen.
In deze gevallen is transplantatie inderdaad de enige effectieve behandeling om te overleven.
Daarom moet elke pathologische aandoening die verhindert dat het orgaan zodanig functioneert dat het voortbestaan van de patiënt wordt bedreigd, worden beschouwd als een indicatie voor transplantatie.
Postoperatieve zorg
Na de transplantatie worden de ontvangers de eerste dagen opgenomen op een voor intensive care ingerichte afdeling, waar de immunosuppressieve therapie wordt gestart.
De patiënt met immunosuppressie heeft isolatie nodig in 'steriele' kamers die speciaal zijn gemaakt om besmetting van welke aard dan ook vanuit de buitenomgeving te voorkomen.
De 'box' waarin de ontvanger na de transplantatie wordt opgenomen, is volledig geïsoleerd van de rest van de reanimatie-eenheid die wordt gebruikt voor conventionele chirurgie.
De toestand van strikte isolatie houdt aan zolang het duurt voordat de patiënt de kritieke postoperatieve fase heeft overwonnen (meestal 5-6 dagen), of in gevallen waarin therapie tegen afstoting vereist is.
Bezoeken aan transplantatiepatiënten
In de onmiddellijke postoperatieve periode zijn bezoeken aan naaste familieleden toegestaan, mits ze gepast gekleed zijn (volgens de procedures voor het betreden van de cleanroom).
Elke persoon wordt één voor één toegelaten tot de filterzone en uiteraard mogen personen met verdenking en/of aanwijzingen van infectieziekten niet worden toegelaten.
Toekomstige ontwikkelingen
De ernstigste problemen in de transplantatiegeneeskunde zijn enerzijds de afstoting van het getransplanteerde orgaan en anderzijds de ontoereikendheid van gedoneerde organen in vergelijking met de benodigde organen.
In beide richtingen wordt er geëxperimenteerd met verschillende oplossingen om deze problemen op te lossen.
Met betrekking tot afstoting worden pogingen ondernomen om oplossingen te creëren die erin slagen het immuunsysteem te misleiden, waardoor de momenteel gebruikte immunosuppressieve therapie wordt verminderd, of die het getransplanteerde orgaan beschermen tegen aanvallen door T-lymfocyten, die verantwoordelijk zijn voor het elimineren van agentia buiten het lichaam .
Aan de andere kant wordt geëxperimenteerd met orgaantekort, kunstmatige organen, tissue engineering of xenotransplantatie die menselijke organen kunnen vervangen.
Gentherapie
Door middel van gentherapie is het mogelijk om naar de bron van het probleem te gaan en genetische defecten direct in de aangetaste cellen, weefsels of organen te elimineren.
Het gezonde gen wordt rechtstreeks op de aangetaste plek ingebracht, waar het die stoffen begint te produceren die het zieke lichaam niet alleen kan produceren.
Gentherapie wordt echter nog lang niet gebruikt. Om vreemd DNA in de celkern te kunnen transporteren, zijn speciale 'vectoren' nodig: virussen die hun infectieuze eigenschappen hebben verloren, maar nog steeds in staat zijn cellen aan te vallen en hun genetische erfenis aan hen over te dragen.
Om afstoting te voorkomen, zou het te transplanteren orgaan in het laboratorium moeten worden behandeld, waarbij genen worden overgedragen die het in staat zouden stellen zichzelf te verdedigen tegen het immuunsysteem van de ontvanger.
Nu zijn de genen bekend, maar er wordt nog niet met de nodige precisie mee omgegaan. De volgende stap is het zoeken naar de perfecte combinatie van genen die de werking van alle immunologische mechanismen van de ontvanger verhindert.
Weefsel engineering
Het doel van deze vorm van therapie is om een alternatief te vinden voor menselijke organen.
Nu al kunnen onderzoekers in het laboratorium weefsels als bloedvaten, hartkleppen, kraakbeen en huid maken.
Het is mogelijk geweest om deze nieuwe grens te overwinnen dankzij het feit dat cellen de neiging hebben om te aggregeren om organen en weefsels te vormen.
Stamcellen
Stamcellen zijn de ongedifferentieerde cellen die een week na de bevruchting in menselijke embryo's worden aangetroffen.
Het zijn ook de 'startcellen' waaruit de weefsels en organen van het te geboren kind zich zullen ontwikkelen.
Hun functie is het reguleren van de omzet van bloedcellen (rode bloedcellen, witte bloedcellen en bloedplaatjes) en die van het immuunsysteem (lymfocyten).
Tegenwoordig worden computergestuurde machines, scheiders, gebruikt om deze cellen te verzamelen, waardoor de benodigde cellen kunnen worden geselecteerd. De ontvangers van de cellen zijn patiënten die lijden aan huidziekten, bloedziekten of solide tumoren.
Naast het feit dat stamcellen nog grotendeels onbekend zijn, is er ook een ethisch probleem: het oogsten van embryonale stamcellen impliceert de dood van het embryo.
Daarom wordt de manier om stamcellen van volwassenen te oogsten geperfectioneerd.
Klonen
De kloontechniek zou het mogelijk maken om het probleem van orgaanafstoting helemaal te omzeilen.
Het zou gaan om het inbrengen van de celkern van de patiënt, met al zijn genetische erfenis, in de stamcel van een menselijk embryo of eicel die voorheen geen eigen kern had.
Deze gemodificeerde cellen, die in vitro in het laboratorium werden gekweekt, zouden genetisch identiek zijn aan die van het immuunsysteem van de patiënt, dat ze niet als vreemd zou herkennen.
Deze techniek is momenteel geen haalbare optie omdat zowel klonen, stamceloogst als het willekeurig gebruik van eicellen bij wet verboden zijn.
Xenotransplantatie
Xenotransplantatie, dat wil zeggen de transplantatie van dierlijke cellen, weefsels en organen in de mens, lijkt de toekomstige oplossing voor het tekort aan organen voor transplantatie.
Experimenten op dit gebied zijn talrijk en worden geconfronteerd met ethische, psychologische en, last but not least, immuunproblemen.
De weinige pogingen die zijn ondernomen (een varkenslever en een bavianenhart getransplanteerd in twee verschillende mensen) hebben niet het gewenste resultaat opgeleverd.
De afwijzingscrisis was in feite bijzonder gewelddadig en onmogelijk te beheersen.
Toch zou deze techniek echt de oplossing kunnen zijn voor het orgaantekort.
In feite wordt het meest gevreesd voor de ontwikkeling van typisch dierlijke infecties, die op de mens worden overgedragen via pathogenen die aanwezig zijn in het te transplanteren orgaan, wat rampzalig zou kunnen blijken te zijn.
Een mogelijk alternatief voor deze handicap zou genetische modificatie op donordieren kunnen zijn; in de praktijk zouden de dieren in een steriele omgeving worden gefokt en genetisch gemodificeerd om hun organen meer compatibel te maken met het organisme van de ontvanger.
Voorlopig zijn er echter enkele mijlpalen bereikt; dit zijn celxenotransplantaties en geen orgaanxenotransplantaties, zoals embryocellen van varkens voor de behandeling van de ziekte van Parkinson, beenmergcellen van bavianen die zijn getransplanteerd in terminaal zieke aids-patiënten in een poging het immuunsysteem van de patiënt te herstellen, of alvleesklier-insulae nog steeds van varkens in de stimulatie van insulineproductie als therapie tegen diabetes.
Orgaantransplantatie: kunstmatige organen
Een andere oplossing voor orgaanfalen zoals afstoting zijn kunstmatige organen.
Het grootste probleem is biologische compatibiliteit; dit zijn immers mechanische organen die zich moeten aanpassen aan een biologisch organisme.
Biocompatibiliteit moet alle morfologische, fysische, chemische en functionele kenmerken omvatten die in staat zijn om te voorzien in de functionaliteit van het orgaan en tegelijkertijd in zijn overleving zonder het risico van afstoting.
Het zijn al deze implicaties die de productie van kunstmatige organen die in staat zijn om 'natuurlijke' organen in hun functies volledig en perfect te vervangen, complex maken.
Lees ook:
Emergency Live nog meer ... Live: download de nieuwe gratis app van uw krant voor IOS en Android
Orgaantransplantatie: diagnose en zorg voor wachtende patiënten
Wat is harttransplantatie? Een overzicht
Hoe wordt een gezichtstransplantatie uitgevoerd? – VIDEO



